研究案内
home > 研究内容
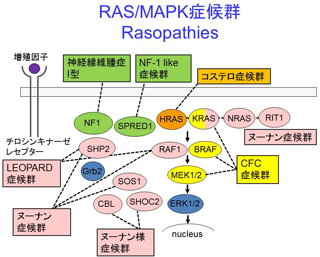 2005年、易発癌性を示す先天奇形症候群であるCostello症候群が、癌原遺伝子HRASの生殖細胞系列の変異が原因であることを世界で初めて同定しました(Aoki Y, et al. Nature Genet, 2005) 。翌年、類縁疾患であるcardio-facio-cutaneous (CFC) 症候群の原因がKRAS、 B型RAFキナーゼ(BRAF)の遺伝子変異であることを報告しました(Niihori T, et al. Nature Genet, 2006)。これらの発見がブレークスルーとなり、RAS/MAPK(mitogen-activated protein kinase) シグナル伝達経路の構成分子(MEK1/2, SOS1, RAF1, SHOC2, NRAS)に次々と遺伝子異常が同定され、類縁疾患の原因が同じシグナル伝達経路の複数の分子であるという、新規の疾患概念を構築するに到りました(RAS/MAPK症候群あるいはRASopathies) 。2013年には次世代シークエンサーを用いてヌーナン症候群の新規原因遺伝子RIT1変異を世界に先駆けて報告しました。これまで機能が不明であったRASサブファミリーのRIT1が古典的癌原遺伝子RAS(HRAS, KRAS, NRAS)と同じ働きを持つ可能性があることを初めて示したことになります (Aoki Y et al. Am J Hum Genet, 2013) 。その後RRAS, RRAS2を新規原因遺伝子として同定しました。
2005年、易発癌性を示す先天奇形症候群であるCostello症候群が、癌原遺伝子HRASの生殖細胞系列の変異が原因であることを世界で初めて同定しました(Aoki Y, et al. Nature Genet, 2005) 。翌年、類縁疾患であるcardio-facio-cutaneous (CFC) 症候群の原因がKRAS、 B型RAFキナーゼ(BRAF)の遺伝子変異であることを報告しました(Niihori T, et al. Nature Genet, 2006)。これらの発見がブレークスルーとなり、RAS/MAPK(mitogen-activated protein kinase) シグナル伝達経路の構成分子(MEK1/2, SOS1, RAF1, SHOC2, NRAS)に次々と遺伝子異常が同定され、類縁疾患の原因が同じシグナル伝達経路の複数の分子であるという、新規の疾患概念を構築するに到りました(RAS/MAPK症候群あるいはRASopathies) 。2013年には次世代シークエンサーを用いてヌーナン症候群の新規原因遺伝子RIT1変異を世界に先駆けて報告しました。これまで機能が不明であったRASサブファミリーのRIT1が古典的癌原遺伝子RAS(HRAS, KRAS, NRAS)と同じ働きを持つ可能性があることを初めて示したことになります (Aoki Y et al. Am J Hum Genet, 2013) 。その後RRAS, RRAS2を新規原因遺伝子として同定しました。
RASopathiesの病態解明と治療法を探索することを目的に、複数のRASopathiesモデルマウスの作製を行っています。
・2014年にはCFC症候群の原因となるBraf変異をもつノックインマウスの作製に成功しました。Brafノックインマウスは胎生致死となりましたが、心疾患、骨格異常、浮腫などCFC症候群の一部を再現しました。治療実験を行ったところMEK阻害剤とヒストン脱メチル化酵素阻害剤マウスの表現型改善に有効であることが明らかになりました(Inoue
S, et al., Hum Mol Genet, 2014; 特願2014-063166)。
・2015年には薬剤投与によって生存したBrafノックインマウスを異なる系統とかけあわせることで、成獣モデルの作製にも成功しました。成獣モデルとなるBrafノックインマウスは成長障害、心疾患、骨格異常、学習障害、外胚葉形成異常などCFC症候群特有の症状を示すことを明らかにしました(Moriya
M, et al., Hum Mol Genet, 2015)。
・2017年にはさらにBrafノックインマウスが食道拡張、前胃上皮の過増殖など消化器系異常を示すことが明らかにり、MEK阻害剤とヒストン脱メチル化酵素阻害剤が消化器疾患の改善にも有効であることが明らかになりました(Inoue
S., et al., Hum Mol Genet, 2017)。・2018年には、軟骨内骨化においてBrafノックインマウスの成長板の層が短くなっていることを明らかにし、その原因が肥大層におけるリン酸化ERKの亢進と、血液内のIGF-1の減少によることを明らかにしました。正常マウスとBrafノックインマウスにC型ナトリウムペプチド(CNP)投与が有効であることを示しました(Inoue
S., et al. Hum Mol Genet, 2018)
・Costello症候群で最も頻度の高いHRAS p.G12S変異をヘテロで持つCostello症候群モデルマウスを世界に先駆けて作製し報告しました。HRAS p.G12S変異をもつマウスは、頭顔部の骨格の変化、心筋肥大を伴う肥大型心筋症などを示しましたが、成長障害などは認められませんでした。Costello症候群の患者さんでは、成長障害や低血糖などを示し、安静時のエネルギー消費が亢進しているという報告もあったので、モデルマウスに高脂肪食を投与したところ、正常マウスに比べて体重増加が少なく、肝臓の小滴性脂肪肝、血中長鎖アシルカルニチンの増加、低ケトン性低血糖などを示し、β酸化異常が疑われました。本報告はCostello症候群にてエネルギー代謝の変化を報告した初めての論文となります(ObaD et al. EBioMedicine, 2018)。
・3つ目の疾患モデルマウスとして、RIT1 A57Gモデルマウスを作製しました 。Rit1A57G/+マウスは、生下時に浮腫などで死亡する個体も多いですが、成獣にて成長障害・頭部の骨格異常・脾臓の肥大を示しました。心臓の所見としては心肥大、心筋細胞肥大と線維化の亢進を認めました。イソプロテレノールで刺激したところ、正常マウスに比べて著明な線維化を認めました。免疫組織化学では筋線維芽細胞のマーカーであるペリオスチンの上昇を認めたため、変異マウスは筋線維芽細胞の増殖とそれに伴う線維化をきたしやすい状態にあると考えられました(Takahara S et al.EBioMedicine, 2019)。
RASopathiesモデルマウスはRIKEN BRCから共同研究ベースで分与可能です。詳細はこちら
無巨核球血小板減少症を伴う橈尺骨癒合症は、血小板を中心とした血球の減少と、前腕の2本の骨が癒合していることにより回内、回外が困難である疾患です。本研究グループは患者さんにおいて、白血病や大腸がん・卵巣がんなどで高発現となるがん原遺伝子であるEVI1にミスセンス変異を同定しました (Niihori T et al. Am J Hum Genet, 2015)。先天性橈尺骨癒合症でがんになりやすいという報告はないものの、過去にEVI1遺伝子全体の欠失を持った人は血球減少を呈したが他の異常はなかったとの報告があることや、今回の3人の患者さんの変異が、MECOMの特定のドメインに集中していることから、EVI1が正常な血球の維持に必要でありミスセンス変異においてもそれが障害されること、およびこのドメインは血球の増殖のみならず前腕の発生に重要な役割を果たしていることが示唆されました。現在MECOM変異の血液細胞や骨形成における病態メカニズム解明研究が進んでいます。
LZTR1変異は、常染色体優性あるいは常染色体劣性遺伝形式のヌーナン症候群で同定され、RASopathiesの中で初めて劣性遺伝形式で発症する疾患の存在が明らかになりました。LZTR1(Leucine Zipper Like Transcription Regulator 1)は癌抑制遺伝子とされ、BTB−Kelchスーパーファミリーに属するタンパクをコードします。この遺伝子は2013年に全身に神経鞘腫を呈するschwannomatosis やglioblastomaに同定されました。 筆者らのグループは、質量分析を用いてLZTR1と結合するタンパク質の同定を試み、LZTR1がRAF1-PPP1CBと複合体を作ることを報告しました (Umeki I et al.Hum Genet, 2019) 。さらにLZTR1を細胞に発現させるとRAS蛋白質が減少することを見出し、LZTR1がRASをポリユビキチン化し分解に関与することを報告しました(Abe T et al.Cell Death Differ, 2020) 。RASの量的制御が細胞増殖、がん発生、あるいは個体の発生にどのような影響があるのかを解明するさまざまなプロジェクトが進んでいます。
リンパ管奇形には、嚢胞性リンパ奇形、リンパ管管腫症GLA, GLAの重症型であるカポジ型リンパ管腫症、骨溶解が主病変のゴーハム病があります。これらの疾患のは長らく不明でしたが、2013年にPIK3CAの活性化変異が嚢胞型リンパ奇形の一部に同定されました。しかしながら、中枢神経系を除く全身臓器にリンパ組織が増殖するリンパ管腫症、GLAの重症系であるカポジ型リンパ管腫症、ゴーハム病の原因は不明のままでした。私達の研究室は、ゴーハム病・リンパ管腫症21家系 の血液DNAを用いた全エクソーム解析や、骨組織など罹患組織部位の解析を行い、KLAの病変組織にNRAS Q61R変異を5%に同定しました (Ozeki M, Aoki Y et al.Orphanet J Rare Dis, 2019)。さらにGorham病における原因遺伝子として、KRAS Q61R変異を世界に先駆けて報告しました (Nozawa A et al.J Hum Genet, 2020) 。当研究室ではいまだ原因不明のリンパ管疾患の原因解明とモデル生物を用いた病態解明を目指しています。リンパ管疾患、 RAS/MAPK経路あるいはPI3K-AKT経路における体細胞変異が見られるため、その経路を標的とした阻害薬が、新しい治療候補となる可能性があります。これらの研究は岐阜大学小児科小関道夫先生達との共同研究です。
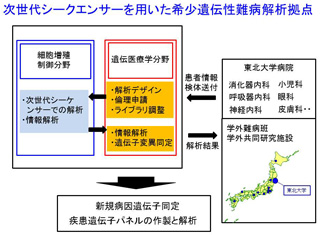 平成23年度に東北大学は厚生労働科学研究費補助金の次世代シークエンサー解析拠点(希少遺伝性難病)に採択されました。次世代シークエンサーを用いた解析パイプラインを構築し、全国あるいは東北大学病院の臨床の先生方の依頼を受け希少遺伝性難病のエクソーム解析を行っています。具体的には臨床各科での原因不明の疾患に対して、研究の進め方、検体採取などに対してのアドバイスを行い、共同にて解析を行っております。実際の高速シークエンサーでの解析は細胞増殖制御分野(中山啓子先生)との共同研究で行ってきました(Izumi
R et al. J Hum Genet. 58:259-66, 2013, Aoki Y et al. Am J Hum Genet 93(1):173-80, 2013, Ninomiya M et al. Hepatol Res. 2013, Ogata T et al. PLoS One. 2014など)。 現在はIRUD(未診断イニシアチブ)との連携を行っています。
平成23年度に東北大学は厚生労働科学研究費補助金の次世代シークエンサー解析拠点(希少遺伝性難病)に採択されました。次世代シークエンサーを用いた解析パイプラインを構築し、全国あるいは東北大学病院の臨床の先生方の依頼を受け希少遺伝性難病のエクソーム解析を行っています。具体的には臨床各科での原因不明の疾患に対して、研究の進め方、検体採取などに対してのアドバイスを行い、共同にて解析を行っております。実際の高速シークエンサーでの解析は細胞増殖制御分野(中山啓子先生)との共同研究で行ってきました(Izumi
R et al. J Hum Genet. 58:259-66, 2013, Aoki Y et al. Am J Hum Genet 93(1):173-80, 2013, Ninomiya M et al. Hepatol Res. 2013, Ogata T et al. PLoS One. 2014など)。 現在はIRUD(未診断イニシアチブ)との連携を行っています。